干細胞是什么?干細胞主要作用是什么?
基本介紹
干(四聲)細胞即為起源細胞干細胞。簡單來講,它是一類具有多向分化潛能和自我復制能力的原始的未分化細胞,是形成哺乳類動物的各組織器官的原始細胞。干細胞在形態上具有共性,通常呈圓形或橢圓形,細胞體積小,核相對較大,細胞核多為常染色質,具有較高的端粒酶活性。干細胞可分為胚胎干細胞和成體干細胞。
胚胎干細胞(Embryonic stem cell)的發育等級較高,是全能干細胞(Totipotent stem cell)
干細胞(1張),而成體干細胞的發育等級較低,是多能干細胞或單能干細胞。據文獻報導干細胞是一類具有自我更新和分化潛能并保持未分化狀態的細胞。它包括胚胎干細胞和成體干細胞。干細胞的發育受多種內在機制和微環境因素的影響。目前人類胚胎干細胞已可成功地在體外培養。最新研究發現,成體干細胞可以橫向分化為其他類型的細胞和組織,為干細胞的廣泛應用提供了基礎。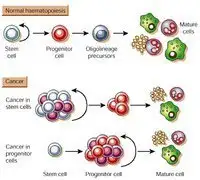
干細胞
在胚胎的發生發育中,單個受精卵可以分裂發育為多細胞的組織或器官。在成年動物中,正常的生理代謝或病理損傷也會引起組織或器官的修復再生。胚胎的分化形成和成體組織的再生是干細胞進一步分化的結果。胚胎干細胞
是全能的,具有分化為幾乎全部組織和器官的能力。而成體組織或器官內的干細胞一般認為具有組織特異性,只能分化成特定的細胞或組織。
然而,這個觀點目前受到了挑戰。
最新的研究表明,組織特異性干細胞同樣具有分化成其他細胞或組織的潛能,這為干細胞的應用開創了更廣泛的空間。
干細胞具有自我更新復制的能力(Self-renewing),能夠產生高度分化的功能細胞。發現
Stem Cell Discovery, a peer reviewed journal, provides a forum for prompt publication of original investigative papers and concise reviews. It will include all the primary discoveries from stem cell basic and translational research, specifically including the fields but not limited as the follows:
“干細胞的發現”是同行評審的開源期刊,由美國科研出版社發行,并且提供了一個論壇,可以迅速發表關于干細胞研究的調查文件和評論。包括所有主要的干細胞基礎研究和轉化研究和發現。包括以下具體的領域:
Stem Cell and Diseases(干細胞研究)
Stem Cell Development and Differentiation(干細胞發育和分化)
Stem Cell Therapy(干細胞療法)
Tissue Regeneration(組織再生)分類
按分化潛能:全能干細胞,多能干細胞,單能干細胞。
按發育狀態:胚胎干細胞,成體干細胞。
全能干細胞:具有形成完整個體的分化潛能,如受精卵。
多能干細胞:具有分化出多種細胞組織的潛能,如胚胎干細胞、誘導性多能干細胞。
單能干細胞:只能向一種或兩種密切相關的細胞類型分化,如上皮組織基底層的干細胞,肌肉中的成肌細胞。
胚胎干細胞:ES細胞是一種高度未分化細胞。它具有發育的全能性,能分化出成體動物的所有組織和器官,包括生殖細胞。研究和利用ES細胞是當前生物工程領域的核心問題之一,在未來幾年,ES細胞移植和其它先進生物技術的聯合應用很可能在移植醫學領域引發革命性進步。
成體干細胞:成年動物的許多組織和器官,比如表皮和造血系統,具有修復和再生的能力。成體干細胞在其中起著關鍵的作用。在特定條件下,成體干細胞或者產生新的干細胞,或者按一定的程序分化,形成新的功能細胞,從而使組織和器官保持生長和衰退的動態平衡。
造血干細胞:造血干細胞是體內各種血細胞的唯一來源,它主要存在于骨髓、外周血、臍帶血中。造血干細胞的移植是治療血液系統疾病、先天性遺傳疾病以及多發性轉移性腫瘤疾病的最有效方法。與骨髓移植和外周血干細胞移植相比,臍血干細胞移植的長處在于無來源的限制,對HLA配型要求不高,不易受病毒或腫瘤的污染。
神經干細胞:神經干細胞的研究尚處初級階段。理論上講,任何一種中樞神經疾病都可歸結為神經干細胞功能的紊亂。給帕金森氏綜合癥患者的腦內移植含有多巴胺生成細胞的神經細胞,可治愈部分患者的癥狀。
周邊血干細胞:骨髓中存有人體內最主要造血干細胞的來源,而周邊血干細胞則是指借由施打白細胞生長激素(G-CSF),將骨髓中的干細胞驅動至血液中,再經由血液分離機收集取得之干細胞.由于與骨髓干細胞極為相近,現已逐漸取代需要全身麻醉的骨髓抽取手術.
脂肪干細胞:以往人們因塑身而抽出的脂肪,大部分都當廢棄物丟掉,現經由醫學專家研究證,脂肪中含有大量的間質干細胞,間質干細胞具有體外增生及多重分化的潛力,能運用于組織與器官的再生與修復.
骨髓間充質干細胞(mesenchymal stem cells,MSC):是干細胞家族的重要成員,來源于發育早期的中胚層和外胚層.MSC最初在骨髓中發現,因其具有多向分化潛能、造血支持和促進干細胞植入、免疫調控和自我復制等特點而日益受到人們的關注.如間充質干細胞在體內或體外特定的誘導條件下,可分化為脂肪、骨、軟骨、肌肉、肌腱、韌帶、神經、肝、心肌、內皮等多種組織細胞,連續傳代培養和冷凍保存后仍具有多向分化潛能,可作為理想的種子細胞用于衰老和病變引起的組織器官損傷修復.骨髓間充質干細胞由于其來源廣泛,易于分離培養,并且具有較強的分化潛能和可自體移植等優點,越來越受到學者們的青睞,被認為是不久即將被引入臨床治療的最優干細胞.[3]
胚胎干細胞的分化性
胚胎干細胞具有萬能分化性(pluripotency)功能,特點是可以細胞分化(Cellular differentiation)成多種組織的能力,但無法獨自發育成一個個體。它可以差轉成為外胚層、中胚層及內胚層三種胚層的成員,然后再差轉成為人體的220多種細胞種類。
萬能分化性是胚胎干細胞與在成年人體內可找到的多功能干細胞的主要分別:多功能干細胞只能差轉成為某幾種特定的細胞種類。在無外界提供差轉的刺激之下(即可在實驗環境下生長),胚胎干細胞在經過多重細胞分裂之后,仍然能保有萬能分化性。成人干細胞能否保有萬能分化性,直到現在仍然有爭議。不過,有研究已示范了萬能干細胞可以從成纖維細胞集叢產生出來。
胚胎干細胞
胚胎干細胞(Embryonic Stem cell,ES細胞)。
胚胎干細胞當受精卵分裂發育成囊胚時,內層細胞團(Inner Cell Mass)的細胞即為胚胎干細胞。胚胎干細胞具有全能性,可以自我更新并具有分化為體內所有組織的能力。早在1970年Martin Evans已從小鼠中分離出胚胎干細胞并在體外進行培養。而人的胚胎干細胞的體外培養直到最近才獲得成功。
進一步說,胚胎干細胞(ES細胞)是一種高度未分化細胞。它具有發育的全能性,能分化出成體動物的所有組織和器官,包括生殖細胞。研究和利用ES細胞是當前生物工程領域的核心問題之一。ES細胞的研究可追溯到上世紀五十年代,由于畸胎瘤干細胞(EC細胞)的發現開始了ES細胞的生物學研究歷程。
目前許多研究工作都是以小鼠ES細胞為研究對象展開的,如:德美醫學小組在去年成功的向試驗鼠體內移植了由ES細胞培養出的神經膠質細胞。此后,密蘇里的研究人員通過鼠胚細胞移植技術,使癱瘓的貓恢復了部分肢體活動能力。隨著ES細胞的研究日益深入,生命科學家對人類ES細胞的了解邁入了一個新的階段。在98年末,兩個研究小組成功的培養出人類ES細胞,保持了ES細胞分化為各種體細胞的全能性。這樣就使科學家利用人類ES細胞治療各種疾病成為可能。然而,人類ES 細胞的研究工作引起了全世界范圍內的很大爭議,出于社會倫理學方面的原因,有些國家甚至明令禁止進行人類ES細胞研究。無論從基礎研究角度來講還是從臨床應用方面來看,人類ES細胞帶給人類的益處遠遠大于在倫理方面可能造成的負面影響,因此要求展開人類ES細胞研究的呼聲也一浪高似一浪。
成體干細胞
成年動物的許多組織和器官,比如表皮和造血系統,具有修復和再生的能力。成體干細胞在其中起著關鍵的作用。在特定條件下,成體干細胞或者產生新的干細胞,或者按一定的程序分化,形成新的功能細胞,從而使組織和器官保持生長和衰退的動態平衡。過去認為成體干細胞主要包括上皮干細胞和造血干細胞。最近研究表明,以往認為不能再生的神經組織仍然包含神經干細胞,說明成體干細胞普遍存在,問題是如何尋找和分離各種組織特異性干細胞。成體干細胞經常位于特定的微環境中。微環境中的間質細胞能夠產生一系列生長因子或配體,與干細胞相互作用,控制干細胞的更新和分化。
造血干細胞
造血干細胞是體內各種血細胞的唯一來源,它主要存在于骨髓、外周血、臍帶血中、胎盤組織中。今年年初,協和醫大血液學研究所的龐文新又在肌肉組織中發現了具有造血潛能的干細胞。造血干細胞的移植是治療血液系統疾病、先天性遺傳疾病以及多發性和轉移性惡性腫瘤疾病的最有效方法。
在臨床治療中,造血干細胞應用較早,在20世紀五十年代,臨床上就開始應用骨髓移植(BMT)方法來治療血液系統疾病。到八十年代末,外周血干細胞移植(PBSCT)技術逐漸推廣開來,絕大多數為自體外周血干細胞移植(APBSCT),在提高治療有效率和縮短療程方面優于常規治療,且效果令人滿意。與兩者相比,臍血干細胞移植的長處在于無來源的限制,對HLA配型要求不高,不易受病毒或腫瘤的污染。
在今年初,東北地區首例臍血干細胞移植成功,又為中國造血干細胞移植技術注入新的活力。隨著臍血干細胞移植技術的不斷完善,它可能會代替目前APBSCT的地位,為全世界更多的血液病及惡性腫瘤的患者帶來福音。
神經干細胞
神經干細胞關于神經干細胞研究起步較晚,由于分離神經干細胞所需的胎兒腦組織較難取材,加之胚胎細胞研究的爭議尚未平息,神經干細胞的研究仍處于初級階段。理論上講,任何一種中樞神經系統疾病都可歸結為神經干細胞功能的紊亂。腦和脊髓由于血腦屏障的存在使之在干細胞移植到中樞神經系統后不會產生免疫排斥反應,如:給帕金森氏綜合癥患者的腦內移植含有多巴胺生成細胞的神經干細胞,可治愈部分患者癥狀。除此之外,神經干細胞的功能還可延伸到藥物檢測方面,對判斷藥物有效性、毒性有一定的作用。實際上,到目前為止,人們對干細胞的了解仍存在許多盲區。2000年年初美國研究人員無意中發現在胰腺中存有干細胞;加拿大研究人員在人、鼠、牛的視網膜中發現了始終處于“休眠狀態的干細胞”;有些科學家證實骨髓干細胞可發育成肝細胞,腦干細胞可發育成血細胞。
隨著干細胞研究領域向深度和廣度不斷擴展,人們對干細胞的了解也將更加全面。21世紀是生命科學的時代,也是為人類的健康長壽創造世界奇跡的時代,干細胞的應用將有廣闊前景。
肌肉干細胞
成肌細胞(myoblasts)可發育分化為成肌細胞(myocytes),后者可互相融合成為多核的肌纖維,形成骨骼肌最基本的結構。
骨髓間充質干細胞
骨髓間充質干細胞(mesenchymal stem cells,MSC)是干細胞家族的重要成員,來源于發育早期的中胚層和外胚層。MSC最初在骨髓中發現,因其具有多向分化潛能、造血支持和促進干細胞植入、免疫調控和自我復制等特點而日益受到人們的關注。如間充質干細胞在體內或體外特定的誘導條件下,可分化為脂肪、骨、軟骨、肌肉、肌腱、韌帶、神經、肝、心肌、內皮等多種組織細胞,連續傳代培養和冷凍保存后仍具有多向分化潛能,可作為理想的種子細胞用于衰老和病變引起的組織器官損傷修復。骨髓間充質干細胞由于其來源廣泛,易于分離培養,并且具有較強的分化潛能和可自體移植等優點,越來越受到學者們的青睞,被認為是不久即將被引入臨床治療的最優干細胞。
骨髓間充質干細胞具有如下的優點:
一.具有強大的增殖能力和多向分化潛能,在適宜的體內或體外環境下不僅可分化為造血細胞,還具有分化為肌細胞、肝細胞、成骨細胞、軟骨細胞、基質細胞等多種細胞的能力。
二.具有免疫調節功能,通過細胞間的相互作用及產生細胞因子抑制T細胞的增殖及其免疫反應 ,從而發揮免疫重建的功能。
三.具有來源方便,易于分離、培養、擴增和純化,多次傳代擴增后仍具有干細胞特性,不存在免疫排斥的特性。
心臟干細胞
以色列的科學家研究出了一種用干細胞做成的心臟,這是由干細胞的分裂形成的。
胎盤造血干細胞
胎盤是胎兒和母親血液交換的場所,含有非常豐富的血液微循環。人在母親子宮內發育的階段,胎盤是首先形成的器官之一。胎盤中含有大量的早期干細胞,包括數量豐富的造血干細胞。這些干細胞在胎盤中行使著造血的功能。小孩出生后剝離的胎盤內所含的造血干細胞,可以分化形成各種血細胞(紅細胞、白細胞、血小板等)的祖宗,注射到體內可以發揮造血功能。
胎盤亞全能干細胞
亞全能干細胞自胚胎形成的第5到7天開始出現,能分化形成200多種人體組織器官細胞,但不能形成一個完整的人體。胎盤亞全能干細胞是來源于新生兒胎盤組織的一族亞全能干細胞,其在發育階段與胚胎干細胞接近,具備分化形成三個胚層的組織細胞的能力,但不會形成畸胎瘤。基礎應用
干細胞的調控是指給出適當的因子條件,對干細胞的增殖和分化進行調控,使之向指定的方向發展。
內源性調控
干細胞自身有許多調控因子可對外界信號起反應從而調節其增殖和分化,包括調節細胞不對稱分裂的人體胚胎干細胞蛋白,控制基因表達的核因子等。另外,干細胞在終末分化之前所進行的分裂次數也受到細胞內調控因子的制約。
⑴細胞內蛋白對干細胞分裂的調控:
干細胞分裂可能產生新的干細胞或分化的功能細胞。這種分化的不對稱是由于細胞本身成分的不均等分配和周圍環境的作用造成的。細胞的結構蛋白,特別是細胞骨架成分對細胞的發育非常重要。如在果蠅卵巢中,調控干細胞不對稱分裂的是一種稱為收縮體的細胞器,包含有許多調節蛋白,如膜收縮蛋白和細胞周期素A。收縮體與紡錘體的結合決定了干細胞分裂的部位,從而把維持干細胞性狀所必需的成分保留在子代干細胞中。
⑵轉錄因子的調控 :
在脊椎動物中,轉錄因子對干細胞分化的調節非常重要。比如在胚胎干細胞的發生中,轉錄因子Oct4是必需的。Oct4是一種哺乳動物早期胚胎細胞表達的轉錄因子,它誘導表達的靶基因產物是FGF-4等生長因子,能夠通過生長因子的旁分泌作用調節干細胞以及周圍滋養層的進一步分化。Oct4缺失突變的胚胎只能發育到囊胚期,其內部細胞不能發育成內層細胞團。另外白血病抑制因子(LIF)對培養的小鼠ES細胞的自我更新有促進作用,而對人的成體干細胞無作用,說明不同種屬間的轉錄調控是不完全一致的。又如Tcf/Lef轉錄因子家族對上皮干細胞的分化非常重要。Tcf/Lef是Wnt信號通路的中間介質,當與β-Catenin形成轉錄復合物后,促使角質細胞轉化為多能狀態并分化為毛囊。
外源性調控
除內源性調控外,干細胞的分化還可受到其周圍組織及細胞外基質等外源性因素的影響。
⑴分泌因子 :
間質細胞能夠分泌許多因子,維持干細胞的增殖,分化和存活。有兩類因子在不同組織甚至不同種屬中成體干細胞在體內發育為不同組織都發揮重要作用,它們是TGFβ家族和Wnt信號通路。比如TGF家族中至少有兩個成員能夠調節神經嵴干細胞的分化。最近研究發現,膠質細胞衍生的神經營養因子(GDNF)不僅能夠促進多種神經元的存活和分化,還對精原細胞的再生和分化有決定作用。GDNF缺失的小鼠表現為干細胞數量的減少,而GDNF的過度表達導致未分化的精原細胞的累積[3]。Wnts的作用機制是通過阻止β-Catenin分解從而激活Tcf/Lef介導的轉錄,促進干細胞的分化。比如在線蟲卵裂球的分裂中,鄰近細胞誘導的Wnt信號通路能夠控制紡錘體的起始和內胚層的分化。
⑵膜蛋白介導的細胞間的相互作用 :
有些信號是通過細胞-細胞的直接接觸起作用的。β-Catenin就是一種介導細胞粘附連接的結構成分。除此之外,穿膜蛋白Notch及其配體Delta或Jagged也對干細胞分化有重要影響。在果蠅的感覺器官前體細胞,脊椎動物的胚胎及成年組織包括視網膜神經上皮、骨骼肌和血液系統中,Notch信號都起著非常重要的作用。當Notch與其配體結合時,干細胞進行非分化性增殖;當Notch活性被抑制時,干細胞進入分化程序,發育為功能細胞[4]。
⑶整合素(Integrin)與細胞外基質:
整合素家族是介導干細胞與細胞外基質粘附的最主要的分子。整合素與其配體的相互作用為干細胞的非分化增殖提供了適當的微環境。比如當β1整合素喪失功能時,上皮干細胞逃脫了微環境的制約,分化成角質細胞。此外細胞外基質通過調節β1整合素的表達和激活,從而影響干細胞的分布和分化方向。
干細胞的可塑性
越來越多的證據表明,當成體干細胞被移植入受體中,它們表現出很強的可塑性。通常情況下,供體的干細胞在受體中分化為與其組織來源一致的細胞。而在某些情況下干細胞的分化并不遵循這種規律。1999年Goodell等人分離出小鼠的肌肉干細胞,體外培養5天后,與少量的骨髓間質細胞一起移植入接受致死量輻射的小鼠中,結果發現肌肉干細胞會分化為各種血細胞系。這種現象被稱為干細胞的橫向分化(trans-differentiation)[5]。關于橫向分化的調控機制目前還不清楚。大多數觀點認為干細胞的分化與微環境密切相關。可能的機制是,干細胞進入新的微環境后,對分化信號的反應受到周圍正在進行分化的細胞的影響,從而對新的微環境中的調節信號做出反應。
克隆豬、克隆羊,其技術的機制原理和干細胞是一致的。歷史情況
干細胞的研究被認為開始于1960年代,在加拿大科學家恩尼斯特·莫科洛克和詹姆士·堤爾的研究之后。體外培養的神經干細胞1959年,美國首次報道了通過體外受精
(ⅣF)動物。
60年代,幾個近親種系的小鼠睪丸畸胎瘤的研究表明其來源于胚胎生殖細胞(embryonic germ cells,EG細胞),此工作確立了胚胎癌細胞(embryonic carcinoma cells,EC細胞)是一種干細胞。
1968年,Edwards 和Bavister 在體外獲得了第一個人卵子。
70年代,EC細胞注入小鼠胚泡產生雜合小鼠。培養的SC細胞作為胚胎發育的模型,雖然其染色體的數目屬于異常。
1978年,第一個試管嬰兒,Louise Brown 在英國誕生。
1981年,Evan,Kaufman 和Martin從小鼠胚泡內細胞群分離出小鼠ES細胞。他們建立了小鼠ES細胞體外培養條件。由這些細胞產生的細胞系有正常的二倍型,像原生殖細胞一樣產生三個胚層的衍生物。將ES細胞注入上鼠,能誘導形成畸胎瘤。
1984—1988年,Anderews 等人從人睪丸畸胎瘤細胞系Tera-2中產生出多能的、可鑒定的(克隆化的)細胞,稱之為胚胎癌細胞(embryonic carcinoma cells,EC細胞)。克隆的人EC細胞在視黃酸的作用下分化形成神經元樣細胞和其他類型的細胞。
1989年,Pera 等分離了一個人EC細胞系,此細胞系能產生出三個胚層的組織。這些細胞是非整倍體的(比正常細胞染色體多或少),他們在體外的分化潛能是有限的。
1994年,通過體外授精和病人捐獻的人胚泡處于2-原核期。胚泡內細胞群在培養中得以保存其周邊有滋養層細胞聚集,ES樣細胞位于中央。
1998年美國有兩個小組分別培養出了人的多能(pluripotent)干細胞:James A. Thomson在Wisconsin干細胞大學領導的研究小組從人胚胎組織中培養出了干細胞株。他們使用的方法是:人卵體外受精后,將胚胎培育到囊胚階段,提取 inner cell mass細胞,建立細胞株。經測試這些細胞株的細胞表面marker 和酶活性,證實他們就是全能干細胞。用這種方法,每個胚胎可取得15-20干細胞用于培養。John D. Gearhart在Johns Hopkins大學領導的另一個研究小組也從人胚胎組織中建立了干細胞株。他們的方法是:從受精后5-9周人工流產的胚胎中提取生殖母細胞(primordial germ cell)。由此培養的細胞株,證實具有全能干細胞的特征。
2000年,由Pera、Trounson 和Bongso 領導的新加坡和澳大利亞科學家從治療不育癥的夫婦捐贈的胚泡內細胞群中分離得到人ES細胞,這些細胞體外增殖,保持正常的核型,自發分化形成來源于三個胚層的體細胞系。將其注入免疫缺陷小鼠錯開內產生畸胎瘤。
2003,建立了人類皮膚細胞與兔子卵細胞種間融合的方法,為人胚胎干細胞研究提供了新的途徑。
2004年,Massachusetts Advanced Cell Technology 報道克隆小鼠的干細胞可以通過形成細小血管的心肌細胞修復心衰小鼠的心肌損傷。這種克隆細胞比來源于骨髓的成體干細胞修復作用更快、更有效,可以取代40%的瘢痕組織和恢復心肌功能。這是首次顯示克隆干細胞在活體動物體內修復受損組織。分類來源
根據其發育階段,干細胞可分為胚胎干細胞(Embryonic Stem Cell)和成體干細胞(Adult Stem Cell)。干細胞種類(4張)胚胎干細胞包括ES細胞(Embryonic Stem Cell)、EG 細胞(Embryonic Germ Cell);成體干細胞包括神經干細胞(Neural Stem Ce11,NSC)、血液干細胞(Hematopoietic Stem Cell,HSC)、骨髓間充質干細胞(Mesen chymal Stem Cell,MSC),表皮干細胞(EPidexmis Stem Cell)等。也有報導,按其分化潛能的大小,干細胞可分為三類:一是全能干細胞(Totipotent Stem Cell),二是單能干細胞(Embryonic Stem Cell),三是多能干細胞(Multipotent Stem Ce11)。 胚胎干細胞可來源于畸胎瘤細胞(EC)、桑椹球細胞(ES)、囊胚內細胞團(ES)、擬胚體細胞(ES)、生殖原基細胞(EG)等。 當受精卵分裂發育成囊胚時,將內細胞團(Inner Cell Mass)分離出來進行培養,在一定條件下,這些細胞可在體外“無限期”地增殖傳代,同時還保持其全能性,因此被稱為胚胎干細胞。胚胎干細胞在培養條件下,若加入白血病抑制因子LIF(Leu kaemia Inhlbitory Factor),則能保持在未分化狀態,若去掉LIF,胚胎干細胞迅速分化,最終產生多種細胞系,如肌肉細胞、血細胞、神經細胞或發育成“胚胎體”。
干細胞按能力可以分為以下四類:
全能干細胞
由卵和精細胞的融合產生受精卵。而受精卵在形成胚胎過程中四細胞期之前任一細胞皆是全能干細胞。具有發展成獨立個體的能力。也就是說能發展成一個個體的細胞就稱為全能干細胞。
萬能干細胞
是全能干細胞的后裔,無法發育成一個個體,但具有可以發育成多種組織的能力的細胞。
多能干細胞
只能分化成特定組織或器官等特定族群的細胞(例如血細胞,包括紅血細胞、白血細胞和血小板)。
專一性干細胞
只能產生一種細胞類型;但是,具有自更新屬性,將其與非干細胞區分開。
成體干細胞可以由下列幾個方面得到:⑴胚胎細胞——由胚胎干細胞定向分化,或移植分化而成。⑵胚胎組織——由分離胚胎組織、細胞分離、或培養而成。⑶成體組織——由臍血、新生兒胎盤、骨髓、外周血、骨髓間質、脂肪細胞等得到。 干細胞是自我復制還是分化成為功能細胞,主要由于細胞本身的狀態和微環境因素所決定。干細胞本身的狀態,包括調節細胞周期的各種周期素(Cyclin)和周期素依賴激酶(Cyclin-Dependent Kinase)、基因轉錄因子、影響細胞不對稱分裂的細胞質因子。微環境因素,包括干細胞與周圍細胞,干細胞與外基質以及干細胞與各種可溶性因子的相互作用。
亞全能干細胞
亞全能干細胞自胚胎形成的第5到7天開始出現,能分化形成200多種人體組織器官細胞,但不能形成一個完整的人體。胎盤亞全能干細胞是來源于新生兒胎盤組織的一族亞全能干細胞,其在發育階段與胚胎干細胞接近,具備分化形成三個胚層的組織細胞的能力,但不會形成畸胎瘤。研究現狀
當前,干細胞和再生醫學的研究已成為自然科學中最為引人注目的領域。中國在干細胞低溫超低溫氣相、液相保存技術、定向溫度保存技術及超低溫干細胞保存抗損傷技術等處于世界領先水平。干細胞理論的日臻完善和技術的迅猛發展必將在疾病治療和生物醫藥等領域產生劃時代的成果,是對傳統醫療手段和醫療觀念的一場重大革命。
采用干細胞治療有著多種優勢:低毒性(或無毒性),即使不完全了解疾病發病的確切機理治療也可達到較好的治療效果,自身干細胞移植可避免產生免疫排斥反應,對傳統治療方法療效較差的疾病多有驚人的效果。
干細胞美容
人體的衰老,皺紋的出現,究其根源實質上都是細胞的衰老和減少。而細胞的衰老和減少則是由干細胞老化引起的。干細胞是各種組織細胞更新換代的種子細胞,是人體細胞的生產廠。干細胞族群的老化嚴重減弱了其增殖和分化的能力,新生的細胞補充不足,衰老細胞不能及時被替代,全身各系統功能下降,讓人一天天老去。而你的皮膚,也因為皮膚干細胞的衰老而無法及時更新,衰老的皮膚得不到修復,所以,你有了皺紋,失去了青春容顏。干細胞美容原理是通過輸注特定的多種細胞(包括各種干細胞和免疫細胞),激活人體自身的“自愈功能”,對病變的細胞進行補充與調控,激活細胞功能,增加正常細胞的數量,提高細胞的活性,改善細胞的質量,防止和延緩細胞的病變,恢復細胞的正常生理功能,從而達到疾病康復、對抗衰老的目的。最新進展
2011年5月,《自然》期刊發表研究報告指出,用皮膚干細胞制成的細胞組織,盡管是來自同一病患體內的細胞,都可能受到病患體內免疫系統的排斥,這項報告讓干細胞治病的前景受到挫折。
研究人員是用與胚胎干細胞類似特點的皮膚細胞,制成誘發性多能干細胞(induced pluripotent stem cells,簡稱iPS細胞)。這種細胞理論上可變為神經、心臟、肝臟或其他器官的細胞,也可進行移植,修補受損的器官。
iPS細胞2007年最初制成時,科學家深感震撼,因為這種細胞具有胚胎細胞缺乏ips細胞在人類研究疾病工作中的用途的兩大優點,一是沒有爭議,無需毀壞人類胚胎;二是因用病患本身的皮膚細胞制成,所以應當不會受到免疫系統的排斥。
但第二個理論上的優點從未經過實際檢驗,直至圣地牙哥加州大學的華裔生物學家徐陽(Yang Xu,音譯)和同事在試驗中才發現,用老鼠皮膚制成的iPS細胞,在屬性相同的老鼠體內受到排斥。
很多科學家也對這樣的結果感到驚訝。高級細胞技術公司科學主管蘭札說:「干細胞的臨床應用前景更加黯淡了。」他說,在老鼠身上的試驗,不清楚是否在人類身上也產生同樣結果,但一些科學家認為,結果可能相同。
一些研究人員數月前指出,iPS細胞可能會產生多種形式的基因突變,最新的研究結果更使iPS細胞的應用前景失色。
波士頓兒童醫院的干細胞移植計畫主任戴利說:「這表明我們對干細胞的本質仍然不甚了解,任何新技術在初期階段都是先表現得癡迷,然後才變得現實,我沒料到會是這樣的結果。」研究意義
分化后的細胞,往往由于高度分化而完全喪失了再分化的能力,這樣的細胞最終將衰老和死亡。然而,誘導性多功能干細胞(iPS)的基本實驗思路動物體在發育的過程中,體內卻始終保留了一部分未分化的細胞,這就是干細胞,干細胞的衰老是機體衰老或人類衰老的重要因素,因而,人體干細胞移植(或注射)對阻止人類衰老意義重大。干細胞又叫做起源細胞、萬用細胞,是一類具有自我更新和分化潛能的細胞。可以這樣說,動物體就是通過干細胞的分裂來實現細胞的更新,從而保證動物體持續生長發育的。
干細胞根據其分化潛能的大小,可以分為兩類:全能干細胞和組織干細胞。前者可以分化、發育成完整的動物個體,后者則是一種或多種組織器官的起源細胞。人的胚胎干細胞可以發育成完整的人,所以屬于全能干細胞。
早在19世紀,發育生物學家就知道,卵細胞受精后很快就開始分裂,先是1個受精卵分裂成2個細胞,然后繼續分裂,直至分裂成有16至32個細胞的細胞團,叫做桑椹胚。這時如果將組成桑椹胚的細胞一一分開,并分別植入到母體的子宮內,則每個細胞都可以發育成一個完整的胚胎。這種細胞就是胚胎干細胞,屬于全能干細胞。骨髓、臍帶、胎盤和脂肪中則可以獲取組織干細胞。每個人的體內都有一些終生與自己相伴的干細胞。但是,人的年齡越大,干細胞就越少。為了彌補干細胞的不足,一些科學家建議從胚胎或胎兒以及其他動物身上獲取干細胞。進行培養和研究。
干細胞的用途非常廣泛,涉及到醫學的多個領域。目前,科學家已經能夠在體外鑒別、分離、純化、擴增和培養人體胚胎干細胞,并以這樣的干細胞為“種子”,培育出一些人的組織器官。干細胞及其衍生組織器官的廣泛臨床應用,將產生一種全新的醫療技術,也就是再造人體正常的甚至年輕的組織器官,從而使人能夠用上自己的或他人的干細胞或由干細胞所衍生出的新的組織器官,來替換自身病變的或衰老的組織器官。假如某位老年人能夠使用上自己或他人嬰幼兒時期或者青年時期保存起來的干細胞及其衍生組織器官,那么,這位老年人的壽命就可以得到明顯的延長。美國《科學》雜志于1999年將干細胞研究列為世界十大科學成就的第一,排在人類基因組測序和克隆技術之前。
新加坡國立大學醫院和中央醫院通過臍帶血干細胞移植手術,根治了一名因家族遺傳而患上嚴重的地中海貧血癥的男童,這是世界上第一例移植非親屬的臍帶血干細胞而使患者痊愈的手術。醫生們認為,臍帶血干細胞移植手術并不復雜,就像給患者輸血一樣。由于臍帶血自身固有的特性,使得用臍帶血干細胞進行移植比用骨髓進行移植更加有效。現在,利用造血干細胞移植技術已經逐漸成為治療白血病、各種惡性腫瘤放化療后引起的造血系統和免疫系統功能障礙等疾病的一種重要手段。科學家預言,用神經干細胞替代已被破壞的神經細胞,有望使因脊髓損傷而癱瘓的病人重新站立起來;不久的將來,失明、帕金森氏綜合癥、艾滋病、老年性癡呆、心肌梗塞和糖尿病等絕大多數疾病的患者,都可望借助干細胞移植手術獲得康復。
同胚胎干細胞相比,成人身體上的干細胞只能發育成20多種組織器官,而胚胎干細胞則能發育成幾乎所有的組織器官。但是,如果從胚胎中提取干細胞,胚胎就會死亡。因此,倫理道理問題就成為當前胚胎干細胞研究的最大問題之一。美國政府明確反對破壞新的胚胎以獲取胚胎干細胞,美國眾議院甚至提出全面禁止胚胎干細胞克隆研究的法案。美國的一些科學家則對此提出了尖銳的批評,他們認為,將干細胞用于醫學研究,在減輕患者痛苦方面很有潛力。如果浪費這樣一個絕好的機會,結果將是悲劇性的。
中國的干細胞研究和應用已經具備了一定的基礎,早在20世紀60年代就開始了骨髓干細胞移植方面的研究,目前研究和應用得最多的是造血干細胞。1992年,中國內地第一個骨髓移植非親屬供者登記組在北京成立,“中華骨髓庫”也正式接受捐贈。2002年,北京建立了臍帶血干細胞庫。關于胚胎干細胞的研究,中國目前還沒有明確的法律規定。 2009年,國家干細胞工程技術研究中心醫學轉化基地在上海成立,干細胞技術進入臨床應用階段。NIH(美國國立衛生研究院)關于胚胎干細胞研究的指導原則。





