深大構(gòu)建新型仿生智能水凝膠干細(xì)胞支架用于輔助干細(xì)胞治療RA
近日,深圳大學(xué)化學(xué)與環(huán)境工程學(xué)院任祥忠教授團(tuán)隊(duì)在期刊《Nature Communications》(影響因子17.694,中科院JCR 1區(qū),TOP期刊)上發(fā)表了題為《Nanozyme-reinforced hydrogel as a H2O2-driven oxygenerator for enhancing prosthetic interface osseointegration in rheumatoid arthritis therapy》的論文。該團(tuán)隊(duì)博士后趙月為第一作者,任祥忠教授、新加坡南洋理工大學(xué)趙彥利教授、吉大二院骨科王金成和李祖浩教授為共同通訊作者。深圳大學(xué)為第一作者單位和通訊單位。

隨著社會(huì)發(fā)展和人類生活水平的進(jìn)步,健康問(wèn)題越來(lái)越成為人們關(guān)注的焦點(diǎn)和熱點(diǎn)。類風(fēng)濕關(guān)節(jié)炎(Rheumatoid Arthritis,RA)是一種以侵蝕性關(guān)節(jié)滑膜炎為主要臨床表現(xiàn)的慢性自身免疫疾病。最新流行病學(xué)調(diào)查顯示,在我國(guó)大陸地區(qū),RA發(fā)病率約為0.42%,且以每年0.7%的速率快速增長(zhǎng),是致殘和造成勞動(dòng)力喪失的主要原因之一。隨著再生醫(yī)學(xué)的不斷發(fā)展,基于干細(xì)胞的RA療法逐漸走進(jìn)大眾視野并受到醫(yī)學(xué)界的廣泛關(guān)注。與傳統(tǒng)治療方法相比,基于干細(xì)胞的治療具有免疫源低、提取率高、微創(chuàng)取材、治療過(guò)程簡(jiǎn)單等特點(diǎn)。尤其是間充質(zhì)干細(xì)胞具有分化為成骨細(xì)胞和軟骨細(xì)胞,修復(fù)損傷關(guān)節(jié)的能力;其免疫調(diào)節(jié)的作用還可以緩解關(guān)節(jié)炎癥,減少滑膜增生。
雖然干細(xì)胞為基礎(chǔ)的治療在風(fēng)濕性關(guān)節(jié)炎的治療中具有優(yōu)勢(shì),但該方法的廣泛應(yīng)用仍面臨一些不可逾越的障礙。首先,在RA病理環(huán)境中,由于關(guān)節(jié)內(nèi)炎癥細(xì)胞的浸潤(rùn)、滑膜組織的增生以及新血管的生成,關(guān)節(jié)內(nèi)形成乏氧微環(huán)境。與此同時(shí),低氧誘導(dǎo)因子-1水平上調(diào),并促使滑膜組織分泌大量的炎胞因子。這些炎癥因子構(gòu)成RA的炎癥微環(huán)境不利于移植干細(xì)胞的存活和分化。此外,RA患者由于長(zhǎng)期處于氧化應(yīng)激狀態(tài),機(jī)體對(duì)活性氧自由基(Reactive Oxygen Species,ROS)的清除能力下降,大量產(chǎn)生和堆積的ROS會(huì)與移植干細(xì)胞中的DNA、蛋白質(zhì)以及脂質(zhì)發(fā)生反應(yīng),進(jìn)而引起移植干細(xì)胞存活率降低,極大地限制了干細(xì)胞治療RA的效果。針對(duì)于以上干細(xì)胞治療RA的現(xiàn)狀,亟待開發(fā)一種高效和生物相容性好的干細(xì)胞自我保護(hù)的載體,來(lái)增加干細(xì)胞的成活和分化能力,從而使干細(xì)胞在RA病理環(huán)境中發(fā)揮最佳的治療效果。
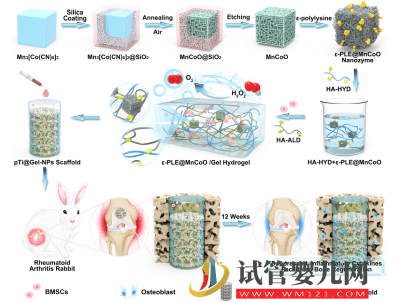
圖1. 仿生智能水凝膠干細(xì)胞支架制備及其用于輔助干細(xì)胞治療RA示意圖
水凝膠是由聚合物分子交聯(lián)而成的三維網(wǎng)絡(luò)結(jié)構(gòu),在介導(dǎo)干細(xì)胞相關(guān)治療的研究中有著巨大潛力和應(yīng)用前景。作為一種含水量極高、質(zhì)地柔軟的高分子材料,水凝膠具有高度可調(diào)的力學(xué)性能、良好的生物相容性、以及易功能化等特點(diǎn)。在結(jié)構(gòu)上,水凝膠與纖維膠原蛋白、肽聚糖等生物大分子和水組成的細(xì)胞外基質(zhì)十分相似,比任何其他種類的合成生物材料更能模擬自然的活體組織。因此,水凝膠被廣泛應(yīng)用于干細(xì)胞載體中。與單純干細(xì)胞移植相比,水凝膠輸送干細(xì)胞進(jìn)行移植治療不僅可以利用凝膠材料本身的特性改善病灶微環(huán)境,還能有效提高移植細(xì)胞的運(yùn)輸率、滯留率和存活率,并對(duì)體內(nèi)移植細(xì)胞的增殖、分化及與宿主的整合發(fā)揮調(diào)控作用。
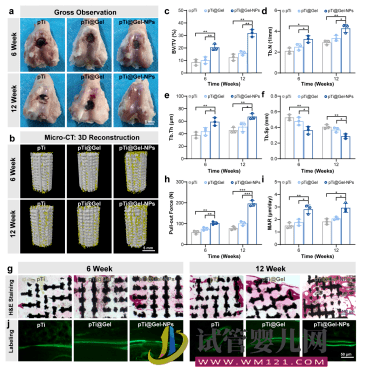
圖2. 納米酶增強(qiáng)水凝膠促進(jìn)骨整合
基于以上考慮,該團(tuán)隊(duì)以動(dòng)物骨基質(zhì)有機(jī)-無(wú)機(jī)雜化結(jié)構(gòu)為啟發(fā),構(gòu)建了一種新型的仿生智能水凝膠干細(xì)胞支架用于輔助干細(xì)胞治療RA。該支架材料由納米復(fù)合水凝膠以及三維打印多孔金屬支架(3D printing porous metal scaffolds,3DPMS)復(fù)合而成。該軟硬結(jié)合的支架充分模擬骨骼組織無(wú)機(jī)-有機(jī)復(fù)合的形貌特征。當(dāng)其作為骨髓間充質(zhì)干細(xì)胞(Bone marrow mesenchymal stem cells,BMSCs)移植過(guò)程中的載體時(shí),3DPMS作為力學(xué)支撐的模板,還可以根據(jù)患者需求個(gè)性化地重建大規(guī)模骨缺損,并且其微孔結(jié)構(gòu)的設(shè)計(jì)對(duì)于維持成骨細(xì)胞形態(tài)并促進(jìn)成骨細(xì)胞的粘附、增殖以及分化具有積極作用。此外,納米復(fù)合水凝膠為干細(xì)胞的存活和功能提供有利的三維微環(huán)境。體內(nèi)動(dòng)物實(shí)驗(yàn)證明復(fù)合支架具有促進(jìn)干細(xì)胞的骨修復(fù)和降低炎癥等作用。這種改善RA病理微環(huán)境的干細(xì)胞載體為實(shí)現(xiàn)RA治療提供新思路,有望進(jìn)一步拓寬納米復(fù)合水凝膠材料在生物醫(yī)學(xué)領(lǐng)域中的應(yīng)用,同時(shí)符合現(xiàn)階段我國(guó)社會(huì)經(jīng)濟(jì)發(fā)展以及滿足人民群眾對(duì)健康生活的迫切需求。
該研究得到國(guó)家自然科學(xué)基金、博士后派出計(jì)劃等項(xiàng)目的聯(lián)合資助。





